牙周膜和牙龈来源的干细胞在肌腱组织再生中的应用
发布:2018-10-30 | 浏览:1325
1. 引言
肌腱连接肌肉和骨并且传递由肌肉产生的力到骨,使关节产生运动 [1]。肌腱经常在运动中或其他重体力活动中受损。因为肌腱的愈合是通过纤维化瘢痕形成而不是一个再生过程,导致低机械强度的劣质组织的形成[1-3],这使得肌腱损伤通常很棘手。因此,肌腱损伤可引起患者长期疼痛,不适和功能障碍。其有限的自我修复能力使得用再生治疗方法来功能性修复肌腱损伤显得尤为必要[3-5]。对比目前的治疗方法,间充质干细胞的应用可能为肌腱再生和修复提供新的治疗选择[6]。间充质干细胞是多能干细胞,根据它们所接受的环境信号,可以分化为多种组织。尤其是关于它们形成肌腱的能力,研究表明直接移植间充质干细胞可以功能性地修复肌腱缺损[6-8]。然而,因为不是所有的间充质干细胞都有同样形成肌腱的能力,选择一个合适的细胞来源是肌腱再生和修复至关重要的一部分。肌腱干细胞,已从人和小鼠的肌腱中被分离和鉴定出来[9],表现出自我更新和多向分化能力。一些研究提出对这种祖细胞对肌腱再生加以应用[8,9]。另外,其他类型的间充质干细胞,包括人的骨髓间充质干细胞和皮肤成纤维细胞[10,11]也被建议应用于肌腱组织工程。
众所周知,间充质干细胞在很多出生后的组织中被发现,包括牙颌面组织[12-15]。因为取材方便,大家对在牙源性间充质干细胞中的牙周膜干细胞和牙龈间充质干细胞很感兴趣,实际上,它们经常取自口腔临床中废弃的生理组织[13-16]。而且,体内外的实验都证实了这些牙源性干细胞的多向分化的能力[13-16]。另外,因为牙周韧带含有肌腱样的胶原束,可以承受口腔咬合力,在肌腱再生治疗中,牙周膜干细胞表现出作为种子干细胞独特的潜力[17]。
为了诱导间充质干细胞向特定期望的组织表型分化,传递一个合适的特定信号是有必要的。有研究报道干细胞介导的组织再生是由受体的局部微环境部分调控的,包括存在的生长因子,免疫细胞和细胞因子[18-21]。因此,将外源性的细胞因子与干细胞一同导入受体,来获得期望的分化途径。本文中,我们关注TGF-β信号通路引导分化成肌腱的潜能。研究表明TGF-β通路在肌腱再生中起着很重要的作用[22,23]。另外,阻断TGF-β信号通路导致大部分肌腱和韧带的丢失。并且,TGF-β信号是Scx(一个基本的螺旋结构转录因子基因,在体内外肌腱细胞唯一的标记物)的强诱导剂,表明TGF-β通路在肌腱再生修复中起着至关重要的作用[23-25]。在TGF-β 大家族的成员中,我们对TGF-β3 特别感兴趣,因为它是一个与促进皮肤伤口和肌腱愈合无纤维疤痕形成有关的同种型(26、27)。其他研究已经证实, 由TGFb3引导的间充质干细胞分化,能促进肌腱组织形成,可能成为一个有前景肌腱再生和修复的治疗方法[24-27]。
为了给牙源性间充质干细胞诱导的肌腱组织再生创造一个有利的微环境,我们寻求去建造一个具有生化特性的胞外微环境。为了修饰微环境特性和引导细胞向特定表型分化,我们将海藻酸凝胶和RGD相结合[28-30]。我们选择的水凝胶生物材料在组织工程中被广泛使用。海藻酸盐是从褐色海藻中分离出来的自然异质多糖,具有独特的属性,比如可注射性和生物可降解性[28-32],此外,海藻酸盐能提供一种利于MSCs的空间分布的三维支架,从而能得到一种类似于体内微环境的结构组织。海藻酸盐微球已被广泛用于生长因子(如TGF-β)的控释,有非常好的安全性(33,35)。并且据报道在海藻酸盐支架中细胞结合多肽(如RGD)是有利的,因为这些多肽模拟了细胞和细胞外基质的相互作用 [31 -33]。
最近,我们的研究团队通过体内外实验发现,结合RGD的海藻酸凝胶可用于复合PDLSCs和GMSCs用作软骨再生 [34]。然而,尚无文献报道在肌腱再生中应用将PDLSCs 或者GMSCs载入RGD修饰装有TGF-β3的海藻酸盐微球中。因此,在本研究中,我们开发了一个能给牙源性MSCs(PDLSCs和GMSCs)的复合提供三维架构的共载体系。我们假设装有TGF-β3,复合PDLSCs和GMSCs的RGD修饰的海藻酸水凝胶微球具有肌腱再生能力,对肌腱组织工程是一项有前景的应用。考虑到GMSCs很容易从口腔中获取,以及可以经常从废弃组织中提取,这些MSC源可以被认为是理想的干细胞库来源,在基于MSC的组织再生中很有潜力。这种方法是为优化肌腱再生设计的,在四肢骨骼的修复上有潜在的应用前景。
2.材料和方法
2.1祖细胞分离和培养
人的PDLSCs和GMSCs是根据此前已表文献中方法的来分离和培养的[15,16],通过了伦理委员会的批准,牙龈组织和牙齿是从二十岁左右的来自南加州大学的健康男性患者的第三磨牙中收集的 (18 -25岁),无任何牙周病史的样本才能被纳入本研究。
2.2 生物材料制备和细胞复合
这项研究使用RGD-coupled海藻酸盐(NovaMatrix FMC Biopolymer, Norway)作为支架材料。根据以往文献中的方法来进行海藻酸的纯化和部分氧化(2%)来增加其降解性[28 -30]。随后,海藻酸盐被收集起来, 在减压下冷冻干燥,和TGF-β3(Invitrogen, Carlsbad, CA) 混合。
PDLSCs、GMSC和hBMMSCs(作为阳性对照)分别复合在含有TGF-β3配体的海藻酸盐中。细胞被复合在海藻酸盐的密度是2*106cells/mL。逐滴把MSC-海藻酸盐混合物添加到100mMCaCl2溶液中形成微球。形成的微球在37℃孵育45分钟来完成交联,然后用不完全DMEM洗三遍。没有细胞(也不带有TGF-β3)的RGD-coupled海藻酸盐水凝胶作为阴性对照。
2.3活细胞/死细胞染色
培养14天后, 复合的MSC细胞的活性如以前文献所述被测量[28、29]使用钙黄绿素染色活细胞和溴化乙锭二聚体染色死细胞(Invitrogen)。用NIH ImageJ测量软件(NIH,Bethesda, MD)测量活细胞的百分比。通过没有RGD的复合牙源性MSC,hBMMSCs的藻酸盐微球培养14天后的活细胞/死细胞染色测定,来评估RGD三肽的存在对复合MSC的活性的影响。
2.4扫描电镜(SEM)
通过扫描电子显微镜(SEM) (JEOL 5300, Peabody, MA)来观察微球的形态和结构特征。在常规培养基培养14天后,MSC藻酸盐微球用2毫升PBS洗一遍,用1%戊二醛固定过夜。样本使用酒精溶液分级脱水,溅射镀黄金,并用扫描电镜观察。
2.5共聚焦激光扫描显微镜(CLSM)
使用CLSM (Fluoview FV10i, Olympus Corp, Tokyo, Japan)进一步来观察复合MSC的藻酸盐微球样品形貌。在培养的第14天,复合的细胞用多聚甲醛(4%)固定30分钟,用PBS(pH=7.4)清洗,然后用0.1%Triton x -100在室温下孵育5分钟。抗CD146-FITC和CD105-PE抗体(Abcam)作为MSC的阳性标记物。此外, 抗CD34-PE抗体(Santa Cruz Biotechnology, Inc.,Santa Cruz, CA)作为阴性标记物。所有的标本用DAPI进行细胞核染色复染。
2.6体外释放曲线
为了描述TGF-β3,RGD-coupled海藻酸微球的释放曲线,我们装载三个不同浓度(10、50和100毫克/毫升) TGF-β3,在500ul high-glucose DMEM与100U/mL青霉素和100ug/mL链霉素在48孔板中培养,37°C摇床一周。在每个选定的时间间隔(1、3、5、7、10、12、14天),收集其培养基,使用TGF-β3 ELISA试剂盒(R&D Systems Inc., Minneapolis, MN)来分析TGF-β3的释放。在释放曲线研究的最后,将余留的TGF-β3从微球中提取出来,通过50 mM柠檬酸钠脱水溶液(Sigma Aldrich, St Louis, MO)在蒸馏水中溶解藻酸盐支架,来测量总共释放的TGF-β3的百分比。最后,释放的TGF-β3的百分比通过两周后的释放量占最初添加量的百分比来计算[48]。
2.7.体外培养和免疫荧光染色
为了诱导腱向分化、复合的PDLSCs和GMSC,hBMMSCs(2*106 cells/ml TGF-β3装载的海藻酸微球)在含有DMEM,15%的血清,2 mML-glutamine,100 nMDex,100 3M ascorbic酸2 Mm sodium丙酮酸(R&D Systems Inc.),100 U /ml青霉素,100ug/ml链霉素的成腱培养基中培养 [26]。无细胞RGD-coupled没有装载TGF-β3海藻酸微球作为阴性对照。
诱导4周后,样本用4%PFA固定,石蜡包埋切片。切片使用一抗Tenomodulin(Tnmd)Eya 1,Eya2(from Santa Cruz Biotechnology, Inc., Dallas, TX),和Scleraxis(Abcam)标记4°C过夜, Alexafluor染料标记的二抗(1:200稀释; Invitrogen)检测,再用DAPI复染。
2.8.RNA提取、逆转录和实时定量PCR
按照以往文献发表的方法将细胞培养2周后,提取RNA [21]。简单地说,10个藻酸盐微球被收集起来,在一个包含50 mM柠檬酸钠脱水溶液和80mM氯化钠(Sigma Aldrich)的无菌解聚缓冲液温和搅拌15 -20分钟使其溶解。溶散后,无荚膜的细胞在9400 g离心机离心10分钟,微球用PBS清洗,9400g再次离心3分钟。根据厂商的建议总RNA使用试剂盒试剂(Invitrogen)提取。100 ng总RNA使用一个标注着III cDNA合成试剂盒(Invitrogen)来合成单链的cDNA。用2DDCt方法进行数据分析,规范化看家基因GAPDH(甘油醛3脱氢酶甘油醛) 的Ct。引物和探针序列在表格1中描述。
2.9.免疫印迹分析
培养四周后,干细胞的分化使用免疫印迹法进行了分析。简单地说,干细胞藻酸盐在柠檬酸缓冲液(6%w/v,pH值7.4)溶解。离心分离得到的细胞球,用PBS洗两次,用蛋白质提取缓冲液(Bio-Rad, Irvine, CA)溶解30s。离心分离弃上清,通过一个已知BSA标准系列浓度在一个数量级连续稀释外推的BCA试验(Pierce, Rockford, IL) 测蛋白浓度。取相同质量的细胞裂解液,上样,电泳,转膜封闭。硝化纤维膜用针对孵化腱调蛋白(Tnmd) (Santa Cruz Biotechnology, Inc.) 的兔抗体孵育。免疫蛋白复合物用1:500 (polyclonal goat anti-rabbit IgG/HRP, EMD Millipore, Billerica, MA) 二抗检测。剪膜,重新用抗b-actin的抗体检测,以保证每一条带添加的质量相同。化学荧光试剂 (Amersham Life Science, Pittsburgh, PA)添加到膜上1分钟, X光片自动洗片机来洗片,曝光不同时间来观察图像。
2.10.肌腱组织再生动物模型
我们体内试验中所有的动物均根据南加州大学对动物的使用和护理指导法规进行处理。PDLSCs、GMSC和hBMMSCs(大约4 *106细胞)复合在装满TGF-β3的藻酸盐微球上,10微球(500毫升)移植入5个月大的裸小鼠(Harlan, Livermore, CA;N?4 for each group)背部皮下。8周后,小鼠被处死,微球和周围组织利用组织学和免疫组织化学切片染色分析。无细胞的没有TGF-β3的RGD-coupled海藻酸微球作为阴性对照。
2.11.组织学和免疫组织化学分析
组织学分析:标本用10%福尔马林溶液固定,在一系列上升浓度的乙醇中脱水,石蜡包埋。用切片机切成6um切片,放在载玻片上。每个移植样本随机选择4个横切片,进行HE和Masson染色,另外,组织切片用偏振光显微镜观察评价胶原合成。
免疫组化分析:石蜡切片浸泡在3%过氧化氢/甲醇15分钟,抑制非特异性内源性过氧化物酶活性。切片用一抗(1:200-1:300稀释)孵育1 h。切片用anti-Tenomodulin (Santa Cruz Biotechnology, Inc., 1:100 dilution),anti-Eya 1, anti-Eya2 (Santa Cruz Biotechnology, Inc., 1:100 dilution), anti-Scleraxis(Abcam, 1:100 dilution) 进行免疫组织化学分析,并用苏木精复染。
RGD三肽对复合MSC肌腱再生能力的的影响与无RGD的藻酸盐微球相比较。将微球用上述方法进行移植,并将切片进行HE和Masson 染色。阳性染色由每个实验组4个独立样本测定。从每个样本随机选择五个区域,然后每一区域阳性染色区用NIH ImageJ软件测量,计算其占总区域的百分比。
2.12.统计分析
用Kruskal-Wallis rank sum test来分析数据,a=0.05为显著性检验水平。同时,如需要时,用two-tailed Student’st-test来进行配对检验。定量数据表示为mean±SD。
3.结果
3.1.生物材料制备和特性
本研究中,我们用一个复合RGD海藻酸盐体系来研究PDLSCs和GMCSs对肌腱组织分化和再生的能力。我们用hBMMSCs复合藻酸盐微球作为阳性对照,而藻酸盐微球作为阴性对照。此外,还检测了RGD-海藻酸对MSC的活性和分化作用。制造的藻酸盐微球的平均直径为1±0.1 mm。复合干细胞的藻酸盐微球纤维图像显示微球有统一大小,甚至表现出一致的细胞分布(图1)。活细胞/死细胞染色证实所有复合的MSC在培养长达两周后有较高的活性(图1 b)。PDLSC、GMSC和hBMMSC组之间的活细胞比例没有明显的差异 (P > 0.05)。此外,细胞在培养两周之后活性仍保持较高的水平(数据没有显示)。此外,在所有测量的时间点里,相比于复合在无RGD耦合海藻酸微球的MSC,复合在耦合RGD的海藻酸微球的MSC表现出更高的活性 (图1 b)。此外,我们对TGF-β3对复合的MSC的影响进行了分析。数据显示RGD三肽的存在对促进MSC活性发挥了重要作用,而TGF-β3配体的存在对MSC活性没有显著性差异(补充图S1)。
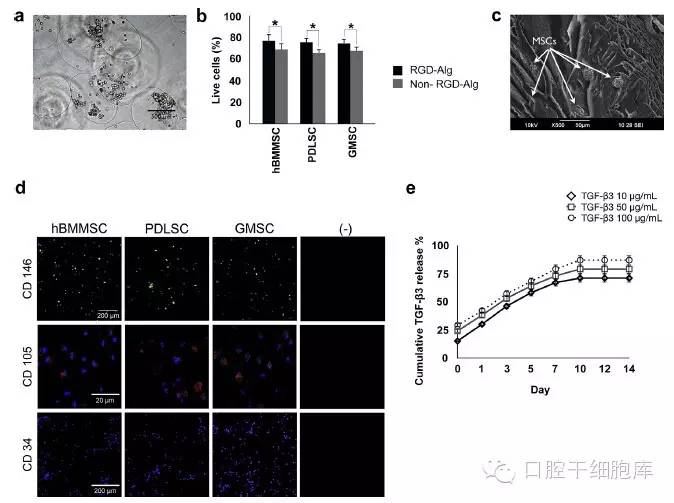
SEM分析表明,我们预备的支架有多孔形态,确认复合干细胞的存在(图1 c)。经过两周的培养,进一步用CLSM检测复合的牙源性干细胞的特性,显示细胞表达干细胞特异性抗体CD146和CD105,但不表达CD34。这些结果证明了RGD耦合的海藻酸盐作为PDLSCs,GMSC以及hBMMSCs复合的生物材料的适用性(图1 d)。
下一步, 预备三种不同TGF-β3浓度(10、50和100毫克/毫升)的藻酸盐微球,描绘两周内TGF-β3从RGD耦合海藻酸支架的释放曲线。观察到高的TGF-β3初始浓度会产生更快的释放曲线(图1 e)。总的释放曲线证实TGF-β3释放长达14天。此外,通过评估最初TGF-β3占配体的比例,我们的数据(图中未显示)证实,50毫克/毫升TGFb3呈现出最好的的释放曲线。因此,接下来的实验研究选择了该浓度。
3.2.牙源性MSC在体外的腱向分化
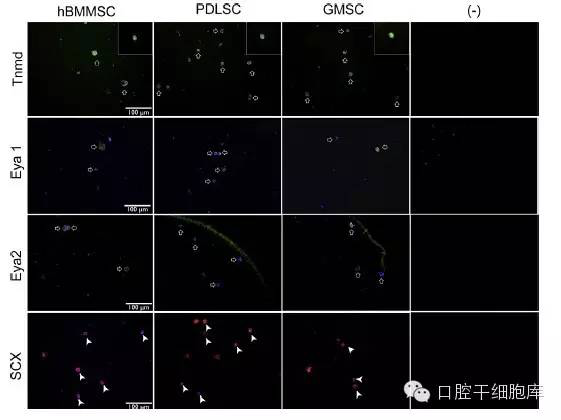
四个星期后,通过与腱调蛋白Eya1、Eya2 Scleraxis抗体的免疫阳性染色证实了PDLSCs、GMSC和hBMMSCs的体外腱向分化(图2)。腱调蛋白(Tnmd)是II型跨膜糖蛋白,主要表达于肌腱和韧带等组织[36]。已经被证实早期表达Scleraxis的祖细胞最终形成肌腱组织[36]。此外,Eya1和Eya2基因在肢体肌腱发育和编码激活转录功能中被表达[46]。这些转录因子参与包括肌腱和韧带发育的许多细胞和发育过程[38]。
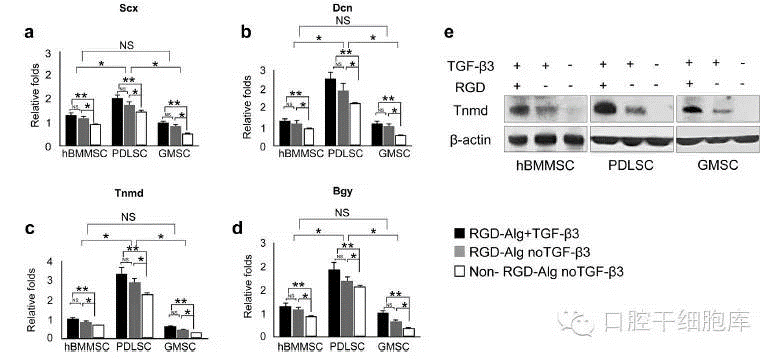
接下来,我们对TGF-β3装载的海藻酸盐微球在肌腱再生中的分子机制进行了研究。用几个与肌腱分化相关的基因标记物来检测相关基因的表达,包括转录因子Scleraxis(Scx),细胞外基质蛋白Decorin(Dcn)和表面标记Tenomodulin(Tnmd)[36-39],以及二聚糖(Bgy),这是一个一型的富含亮氨酸的蛋白多糖(SLRP),参与调节胶原蛋白的原纤维形成[47]。这些基因的表达水平是通过RT-PCR来证实和比较。结果表明,所有的MSC团体表达了大量的Scx,DCn、Tnmd Bgy(图3)。然而对所有的检测基因,PDLSCs比GMSC或hBMMSCs有显著更高的表达水平(p < 0.05)。在Scx,DCn Tnmd或Bgy表达水平上,hBMMSCs和GMSC之间没有的显著差异(P > 0.05)。然而,对于所有的测试基因,hBMMSCs比GMSC有更高的表达。正如所料,MSC复合耦合RGD的海藻酸盐微球比未耦合RGD 的海藻酸盐微球在肌腱特异基因表达水平上有显著提高(P < 0.05)(图3 a-d)。此外,进一步的分析清晰地证实在细胞腱向分化中,TGF-β3比RGD扮演着更重要的角色。此外, 在TGF-β3配体存在下,对体外腱向分化两周的没有支架复合的hBMMSCs PDLSCs,GMSC的Dcn和Tnmd表达水平进行检测。有趣的是,在无支架标本的细胞中有相同趋势(图3 a-d)(补充图S2)。然而,相比无支架复合的MSC,复合细胞表达较高肌腱标记物水平(p > 0.05),确认复合生物材料的重要作用(补充图S2)。
免疫印迹分析的结果与免疫染色和PCR分析一致。在复合TGF-β3耦合RGD藻酸微球中发现,肌腱特异分子Tnmd呈高表达水平 (图3 e)。相比之下,MSC复合在未耦合RGD但仍装载TGF-β3的藻酸盐微球中,则显示不高的Tnmd表达水平,而没有TGFb3和RGD的样本不表达Tnmd(图3)。在复合TGF-β3耦合RGD藻酸微球的PDLSCs比hBMMSCs或GMSC表达更高水平的Tnmd.
3.3.体内异位肌腱再生
我们通过免疫疫缺陷的老鼠皮下异位移植实验评估PDLSCs和GMSC复合在RGD耦合的装载TGF-β3的藻酸盐微球中再生肌腱组织的能力。组织学切片HE和Masson染色显示了波形排列的腱样结构的纤维存在。然而, PDLSCs组相比GMSC和hBMMSCs组含有更多的细胞外基质和胶原蛋白的组织结构 (图4)。实验和阳性对照组三色染色进一步证实了移植8周后肌腱样组织的存在,但在阴性对照组,无细胞移植组,没有组织学证据显示肌腱样组织再生。另外,为了检测胶原的沉积水平,我们在偏振光显微镜下观察组织水平切片(图4 b)。PDLSC组比hBMMSC,GMSC组观察到更多的黄色(网状)染色的胶原。组织形态分析证实,MSC复合在RGD耦合海藻酸盐微球比不含RGD组表现出更高的肌腱组织再生量(通过Massion染色)(图4 c)
用免疫组化来检测基因表达蛋白从而进一步描述牙源性MSC介导的肌腱体内再生的特性。移植8周后,免疫组织化学染色表明在新生的肌腱组织中,Scleraxis Tenomodulin,EYA 1,和EYA2抗原有大量表达和沉积(图5)。正如所料, PDLSC组比GMSC组或hBMMSC组产生更多的肌腱样组织(P < 0.05)(图5 b), 免疫组织化学检测Scx蛋白显示,GMSC和hBMMSCs表现出相当的肌腱再生的潜力(P < 0.05)。PDLSC组比GMSC组或hBMMSC组显示相当高比例的anti-Scx抗体阳性染色(图5 b)。另外,我们通过免疫组织化学染色确认人来源的新生肌腱组织(图5)。无RGD耦合的海藻酸盐的阴性对照组中,没有观察到anti-Scx抗体阳性细胞。
4.讨论
因年龄增长肌腱退化或者高强度的体育活动带来的肌腱损伤是一种常见的临床问题,受损的肌腱组织愈合非常缓慢,很少可恢复到正常未损伤肌腱的完整结构或机械强度[36]。对基本的肌腱生理有限的理解已经阻碍了肌腱受损新治疗方法的发展(1、40)。肌腱再生治疗中,局部载入生长因子结合MSC是一种有前景的治疗方法。一些动物研究已经证实,应用MSC可显著改善肌腱修复和再生(41,,42)。由于牙周韧带含有肌腱样胶原束的结构,我们假设PDLSCs可成为一个适合肌腱再生的独特的细胞来源。此外,GMSC以及PDLSCs在一定程度上,很容易从口腔或废弃生物样品中获得。因此,这些MSC可以认为干细胞组织再生中干细胞库的理想细胞来源。然而,据我们所知,PDLSCs和GMSC肌腱组织再生的能力此前没有被报道。因此,本研究利用海藻酸盐微球耦合RGD三肽装载TGF-β3的方法来改善牙源性细胞分化成肌腱样组织的微环境,同时也评估从牙周膜和牙龈中提取的干细胞与这些海藻酸盐微球复合,参与肌腱再生的能力。
通过体外或体内研究,我们证明了这个复合体系能够支持干细胞的活性和分化成肌腱样组织。我们也确认了微环境对复合细胞活性的重要作用。此外,在当前的研究中,我们采用两个独特的,方便获得和来源丰富的牙源性MSC(PDLSCs和GMSC),表明它们在肌腱组织再生中是很有前景的种子细胞。从实用的角度来看,考虑它们的易获得性和自体移植的适用性,PDLSCs和GMSC比hBMMSCs更有优势。因此,人PDLSC或者GMSC介导组织再生在细胞治疗肌腱组织工程显示了很好的前景。牙源性MSC复合在藻酸盐微球在一个合适的信号分子诱导下(在本研究中,TGF-β3)可以有效地诱导再生肌腱样组织的模式基因表达。
本研究中,我们发现牙周韧带来源的MSC比hBMMSCs有更高水平的肌腱标志mRNA的表达,从牙龈组织中提取的干细胞表现出与hBMMSCs相当的表达水平。另外,在我们的体内研究中,新生组织的组织学分析确认典型肌腱样组织的形成,包括细胞核和细胞质正弦波动的模式。也确认了我们的假设:PDLSCs比GMSC或hBMMSCs将显示更强的肌腱组织再生能力。有趣的是,GMSC显示与hBMMSCs相当的肌腱再生能力。然而,PDLSCs和GMSC有一个超过hBMMSCs的独特的优势,即它们的易获得性和肌腱形成的高能力,这与需要更多获得量和有成骨倾向的hBMMSCs形成鲜明对比。这种骨生成倾向是一个主要的考虑,因为骨组织生成是一个可能会导致临床肌腱再生的应用中严重的不良反应。相比之下,HE和三色染色确认,移植的PDLSCs和GMSC没有观察到成骨分化。此外,通过qPCR检测(数据如图所示),含TGF-β3的培养基培养的PDLSCs和GMSC在体内没有显示成骨标记物例如OCN和ALP等的表达水平增加,而观察到Scx,Dcn Tnmd,Bgy表达水平的增加几乎三倍.
已经证明, MSC-based再生疗法的有效性中,细胞的传递载体起着关键的作用(43 -45)。在本研究中,我们利用RGD耦合海藻酸微球作为牙源性MSC的复合载体。这个复合系统提供了一个独特的肌腱组织工程3d细胞交架。SEM分析表明,藻酸盐微球具有多孔结构,利于氧、营养和信号分子在海藻酸水凝胶的扩散。这种结构特点也使生长因子如TGF-β3等穿透海藻酸微球并参与调节复合MSC的增殖和分化。这种独特的结构特性结合RGD三肽,旨在促进MSC与海藻酸微球相互作用,增强MSC的的附着力和氧气、营养物质及理想的生长因子可用性。这些属性使海藻酸凝胶成为肌腱组织工程中合适的生物材料支架。
事实上我们目前研究的一个极有前景的方面是,在体内实验或皮下移植之前,并不需要将MSC在肌腱组织诱导介质中培养。我们研究证明,提供良好的微环境和一个来自TGF-β3的启动信号足以促进肌腱组织的形成。目前的研究结果证实了适当细胞因子的重要性,特别是TGF-β3支持复合牙源性干细胞形成肌腱组织。这些结果强调微环境发挥的重要作用,有支持细胞的生存提供分化表型必要的感应信号的作用。
在这里,我们探索建立牙源性MSC作为肌腱组织的再生的种子细胞。因此,我们的主要目标之一是确定这些细胞在体内异位再生模型中的可塑性。在我们未来的工作中,将这些牙源性MSC和RGD耦合海藻酸的复合体系用于肌腱组织再生,将来可能应用到临床中。
5.结论
在当前的研究中,我们发现了应用于肌腱再生的牙源性干细胞PDLSCs和GMSCs, 使用可注射和可生物降解的RGD耦合海藻酸水凝胶支架来支持细胞分化的替代治疗方法。MSC和海藻酸结构能够有效促进细胞外基质分化为肌腱组织。我们的发现表明,微环境以及感应信号(TGF-β3)对牙源性MSC的活性和向肌腱样组织分化起着重要的作用。





