包裹牙源性间充质干细胞的支架材料在骨组织工程中的应用
发布:2018-10-26 | 浏览:1130
目前,骨缺损最常见的治疗方法是自体和同种异体骨移植。然而,这些治疗方式存在一些不足,如供区并发症、血肿、炎症、疼痛,以及获取骨组织较高的成本1-3。因此,其替代品显得尤为需要。骨组织工程期许能研发出具有恢复、维持或改善骨组织功能的生物骨替代品。骨组织工程的最终目标是能够构造出与天然骨组织物理和生物属性类似的结构。
间充质干细胞能够使受损的组织高质量的再生,而无纤维组织的形成,同时与自体移植相比最大程度的减小了供区并发症,降低了自体免疫排斥和疾病传播的风险,因而表现出成为组织再生治疗中一个有利的治疗选择4。此外,干细胞能产生多种专能细胞类型,并在多种成体组织中广泛分布,使其成为骨再生应用中的具有吸引力的目标。目前已有多种类型的牙源性间充质干细胞被分离和鉴定,包括牙髓干细胞5,来源于脱落乳牙的干细胞6,牙周膜干细胞(PDLSCs)7,来自根尖乳头的干细胞8和最近的牙龈间充质干细胞(GMSC)9。这些干细胞在颅颌面的应用十分具有吸引力,因为它们可能比非牙源性干细胞更易于分化为颅颌面组织。有研究报道, 活体外使用羟基磷灰石/磷酸三钙(HA / TCP)作为载体,将PDLSCs移植到免疫缺陷小鼠能够再生一个典型的牙骨质、牙周膜样结构8。Lindroos等人在他们的研究证实了PDLSCs具有成骨、成脂和成软骨的多能分化潜力10。最近,GMSC已被证明具有于人骨髓间充质干细胞(hBMSCs)类似的干细胞特性和免疫调节能力。
牙龈组织作为一个干细胞来源的优势,在于牙龈不仅易从口腔获取,也可以经常从废弃的生物样本上获得9,11。王等人证实GMSCs可以在8周内修复大鼠手术制造的下颌伤口和颅骨缺陷,并认为GMSCs可能成为干细胞治疗为基础的骨组织再生中的新型细胞来源,具有重要的临床应用价值1 2。其他一些研究已经充分地表明这些类型的间充质干细胞的自我更新和多能分化潜力13,14。Mitrano等人报道,GMSCs与具有多能分化的人骨髓间充质干细胞类似,在特定的分化条件下可以分化成骨、成软骨和成脂13。有趣的是,Tomar 等人报道GMSCs与hBMSCs相比更具优势:GMSCs很容易分离,无并发症和疤痕形成,且比hBMSCs的同质性更好,增殖速度也更快14。
然而在所有上述研究中,均以HA / TCP的混合物作为干细胞的载体。有理由相信,会有其他更高效的生物材料(如藻酸盐水凝胶)可以为这些新型的牙源性干细胞提供一个更适宜的三维(3D)、可生物降解的载体。骨组织工程中,可生物降解的生物支架材料和干细胞之间的交互作用非常重要。因此, 功能性组织的形成需要细胞水平最佳的交互作用1-3。许多可生物降解的生物材料,包括藻酸盐水凝胶、PLGA、聚已酸内酯已应用于骨组织工程。研究已经证实,在这些应用中,海酸盐水凝胶是一种极佳的可生物降解的支架15-17。
藻酸盐是从棕色海藻中提取的天然多糖。他们属于一个由(1 - 4)-连接-D-甘露糖醛酸(M部)和(1 - 4)-连接-L-古罗糖醛酸(G单位)残端构成的线性聚阴离子共聚物家族15,16。在体外,离子键交联的藻酸盐的力学性能随着时间而下降,这可能是由于交联的离子外流到周围介质造成的。此外,藻酸盐的分子量及降解特性可通过氧化程度调控17,18。由于其内在的生物相容性,易于调控的免疫抑制以及降解特性,藻酸盐一直被认为是植入生物材料中的极佳选择18,19。为了实现组织工程,包裹干细胞的支架成为另一个潜在的,并在微流体领域内愈加引起关注的应用20,21。通过化学修饰,藻酸盐可以获得降解性、增强细胞结合或传递各种信号分子于包裹的细胞22,24。然而,据我们所知尚无应用藻酸盐水凝胶作为PDLSCs和GMSCs支架的研究。本实验,我们展示了藻酸盐水凝胶作为一个可注射、可降解的三维生物支架,适于包裹PDLSCs和GMSCs,并可以在体外和体内研究中促进功能性的骨组织再生。
材料和方法
材料
超纯的海藻酸盐于ProNova Matrix Biomedical (挪威) 购得。除另有说明,所有的化学制品,包括活性炭、氯化钙、高碘酸钠,氯化钠、磷酸钠、柠檬酸钠二水合物,二甲苯酚橙(XO)和乙二醇均于Sigma-Aldrich(圣路易斯,密苏里州)购得。
干细胞的培养、生物材料的制备和包裹
人PDLSCs、GMSCs和BMSCs依照之前发表的规程被分离和培养8,9。根据南加州大学的IRB协议(10941),牙齿和牙龈组织获得于健康男性患者(18-25岁)被拔除的第三磨牙。干细胞经鉴定,于第四代应用于所有的实验。hBMSCs作为阳性对照组。
藻酸钠以1%(w / v)的浓度溶解于去离子水,使用活性碳(0.5 g 活性炭/ g藻酸盐)纯化以去除有机杂质,以提高整体藻酸盐的纯度。活性炭处理之后,藻酸盐溶液使用无菌的0.22μm滤器过滤,在灭菌的锥形管(Millipore, Billerica, MA)中冻干,并在无菌环境下分装。在铝箔包装的1 L锥形烧瓶内,搅拌纯化的藻酸盐钠(4.0 g)至溶解双蒸水(40 ml)。之后加入高碘酸钠溶液(0.5 M,40 ml),在室温搅拌反应过夜。再向反应的混合溶液中加入乙二醇(40 ml)以减少其余未反应的高碘酸混合物。室温下搅拌两个小时后再过滤。溶液在减压环境下浓缩至100 ml,然后在减压环境下冻干制成白色絮状的样品。
PDLSCs、GMSC和BMSC均分别以100万细胞每毫升藻酸盐溶液(1%氧化)的密度包裹于藻酸盐中。微珠是通过注射器挤压藻酸盐-干细胞滴于100 mM氯化钙溶液内形成。藻酸盐液滴交联形成微珠。
微珠在37度下孵育45分钟形成完全交联的球体,然后用非补充的DMEM洗三遍。在孵育微珠的孔板里无可见的干细胞,以确认干细胞被包裹在水凝胶球形结构中。未包裹细胞的藻酸盐微珠作为阴性对照组。
活/死细胞染色
在常规培养基中培养1、7、14和28天,对包裹的细胞进行活/死细胞鉴定。弃去培养基,用Dulbecco’s 磷酸盐缓冲液(pH57.2, PBS)清洗干细胞-藻酸盐微珠。每个样本加入含有0.002 mmol/ L钙黄绿素和0.002 mmol/ L溴乙啡锭二聚体(均来自 Invitrogen, Carslbad, CA)的2.0毫升的培养基(无血清)。荧光显微镜(奥林巴斯IX71数码相机,奥林巴斯光学有限公司)用于观察细胞。图像使用分析成像软件套件(Soft Image System GmbH, 德国)进行捕捉和分析。活细胞被钙黄绿素中的绿色荧光染为绿色,表明细胞内酯酶的活性;死亡细胞被溴乙啡锭二聚体中的红色荧光染为红色,表明细胞膜完整性的破坏。活细胞百分比和活细胞密度依照之前的文献,使用ImageJ software软件测量获得25。此外,藻酸盐支架的生物降解性对包裹的干细胞活性的影响也被进行了研究。根据上述方法使藻酸盐水凝胶在不同的速率(0,1,5%)下氧化,常规细胞培养基中培养1天后对每种类型的包裹的细胞进行活/死细胞鉴定。
包裹的干细胞的体外成骨诱导
将细胞培养基更换为成骨培养基,含有a-MEM,10% FBS,1% 青霉素,链霉素和地塞米松(0.1mM), b-甘油磷酸(10 mM)和抗坏血酸(50 mg/ml),用于诱导成骨。此外,培养基还加入了1.8 mM的磷酸二氢钾(Sigma)及10 mM地塞米松。藻酸盐微珠在成骨培养基中培养1到4周。未封装细胞的微珠作为阴性对照组。为评价各组细胞的成骨分化能力,对细胞进行了XO染色, 这种荧光探针可通过螯合钙将矿物染为红色,从而鉴定培养基中钙化物的存在。
组织化学染色
对于组织化学分析,藻酸盐水凝胶微珠在多聚甲醛4%(v / v)中室温固定30分钟,后置于PBS 15分钟,再进行脱水。微珠放入系列连续增加浓度的乙醇溶液中脱水,以去除所有水分。将乙醇替换为系列增加浓度的二甲苯溶液直到100%,之后在石蜡饱和的二甲苯溶液室温孵育过夜。微珠被连续切片(6μm)并附着于载玻片上。此外,石蜡被浸于二甲苯,后于浓度连续降低的乙醇系列溶液,最后用自来水冲洗,去除所有石蜡。XO也用于成骨鉴定。XO溶解在水中形成1mM的溶液,随后使用无菌过滤器过滤。藻酸盐微珠被除去,并用PBS清洗。样本中加入2 ml的1mM XO孵育过夜。荧光成像之前,弃掉含有荧光素的培养基,更换为常规培养基,以防止非特异性荧光背景。对每个样品采集荧光图像。每个样品矿化面积依照以前报道的方法计算26,27。图片使用使用奥林巴斯DP50数码相机(奥林巴斯光学有限公司)获取,使用分析成像软件(Soft Image System GmbH,德国)进行分析。通过计算每个图像矿化区域,使用Image J软件对每个时间段的矿化程度进行定量。
反转录和多聚链式反应(RT-PCR)
成骨培养基中培养4周后,收集10ml藻酸盐水凝胶微珠,在含有50 mM柠檬酸钠和80mM氯化钠的无菌解聚缓冲液(Sigma-Aldrich)中缓慢搅拌15 - 20分钟溶解,以获得包裹的细胞中的RNA。溶解后,将解封装的细胞以10000 RPM的速度离心10分钟,用PBS洗细胞沉淀后再以10000 RPM的速度离心3分钟。细胞沉淀冻存在-80度,后依照说明书使用Trizol 试剂盒(Invitrogen, Carlsbad, CA)提取总RNA。使用Superscript III cDNA 合成试剂盒(Invitrogen)及100 ng总RNA合成单股cDNA。每个mRNA的相对产量由内源性的看家基因GAPDH确定和标准化。引物和探针序列如表1所示。对PCR产物进行1%的琼脂糖凝胶电泳,再进行溴化乙锭染色,并在紫外光下观察。为包裹细胞的藻酸盐微珠为本研究中的阴性对照。
碱性磷酸酶活性
对硝基苯磷酸比色测定(Abcam, Cambridge, MA)用于检测藻酸盐微珠中干细胞的碱性磷酸酶活性。在成骨培养基中培养1 - 3周后,用PBS洗清干细胞-藻酸盐结构3遍。随后,在含有50 mM柠檬酸钠和80mM氯化钠的解聚缓冲液中37度孵育20分钟,以溶解藻酸盐。离心分离和溶解,收集细胞,然后在每个样本的培养基中加入碱性磷酸酶反应缓冲液。标准对照液(Stanbio)含已知碱性磷酸酶浓度的ALP,用做标准品。碱性磷酸酶的活性水平通过细胞溶解产物中总DNA的量进行标定25,26。常规培养基培养的样品做为对照组。
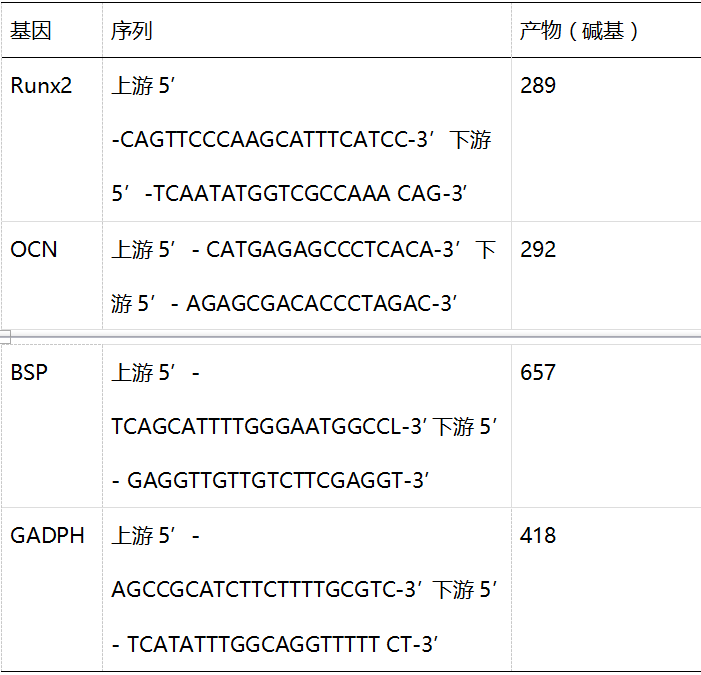
表1 RT-PCR多碱基引物
共聚焦显微镜扫描
培养后14天,培养在常规培养基的包裹的细胞被固定在甲醛(4%的 PBS)中30分钟,再用PBS(0.01 M,pH=7.4)清洗,之后在1%的 Triton X-100室温孵育5分钟。PBS多次清洗样本后,使用抗人CD146-FITC共轭和抗人CD73-tric共轭,在37度下孵育1小时,与14,6-二氨基-2-苯茚二酮盐酸盐(DAPI)对细胞核染色10分钟复染以标记细胞,使用CLSM的滤器在488nm的激发光下检测。抗人CD34-TRITC共轭标记的细胞为阴性对照。
扫描电镜
使用扫描电子显微镜(SEM)(JEOL 5300, Peabody,MA)检测样品。包裹于藻酸盐微珠中的干细胞使用2毫升PBS中荡洗,并使用1%戊二醛固定过夜。样品使用梯度酒精溶液脱水和喷金。每组扫描五个样品:(1)只有藻酸盐的微珠组,(2)在常规培养基中培养、包裹有干细胞的藻酸盐微珠组,(3)在成骨培养基中培养4周、包裹有干细胞的藻酸盐微珠组28。
体内实验(动物模型)
PDLSCs、GMSC经过培养和扩增后(hBMSCs作为阳性对照组),包裹有干细胞的藻酸盐微珠(约0.5 mL/ 0.5×106 细胞)植入5个月大Beige nude XID III(nu/nu)(Harlan, USA)小鼠(每组6只)背部皮下。包裹有干细胞的藻酸盐微珠在移植前未进行体外培养。所有动物的处理均依照南加州大学实验动物使用、护理的指导方针和规定。8周后小鼠被处死,肌肉组织用于观察异位矿化组织的生长。以上程序均按照批准的动物协议(USC # 10941)中的内容进行。小鼠处死前进行标准射线照相,处死后收集标本用于组织学分析。
MicroCT 分析
对收集的动物样本进行高通量MicroCT 扫描(MicroCAT II, Siemens Medical Solutions Molecular Imaging, Knoxville, TN)以评价异位成骨。标本以每10微米60 kV和110 微安的窗宽, 18.676毫米(立体像素尺寸)的空间分辨率扫描。使用Amira software(Visage Imaging, San Diego, CA)计算每个干细胞-藻酸盐微珠的骨体积分数(BV /TV)。
组织学和免疫组织化学研究
收集的动物样本于10%福尔马林固定,,10% EDTA缓冲液脱钙,后石蜡包埋。依据之前发表的方法对组织块脱蜡然后行HE染色,在显微镜下观察9。此外,对石蜡包埋的切片行抗人线粒体的一抗孵育,用通用的免疫过氧化物酶(HRP)ABC 试剂盒(Vector Laboratories)观察。样本使用苏木精进行复染。组织学染色的切片进行成像并使用NIH ImageJ 软件进行组织形态学分析。定量数据使用平均值和标准偏差(SD)表示。多个样本均值的比较在显著性a=0.05水平上分别进行进行单向和双向方差分析以及T检验。
结果
本实验研究研制了藻酸盐微胶囊培养系统,为诱导PDLSCs、GMSC分化以应用于骨组织工程。包裹在藻酸盐微珠中的hBMSCs为阳性对照组。细胞培养结果表明,细胞培养72小时后,PDLSCs和GMSC融合率超过90%,而hBMSCs低于50%(结果未展示)。此外,以5× 105个细胞接种3代后,hPDLSCs和GMSC的细胞数显著高于hBMSCs(p < 0.05)[图1(a)]。
包裹于藻酸盐中干细胞的特征
包裹有干细胞的藻酸盐微珠的平均直径为1±0.1mm。显微镜图像显示包裹的干细胞的微珠大小一致以及细胞分布 [图1(b,c)]。海藻酸盐微珠保持圆形形态,培养一周后细胞群落更加明显。
活/死细胞鉴定证实在培养的早期阶段,包裹的细胞活性较高 [图. 1(d)]。此外,在诱导分化培养的后期阶段,随着组织的形成,细胞的活性依旧保持在较高水平。在聚集物内未发现中心区坏死,表明微珠内营养供应是充足的。定量分析显示PDLSCs、GMSC和hBMSC各组的活细胞百分率没有显著性差异(p>0.05)[Fig. 1(e)]。包裹的干细胞培养4周后仍具有活性,而且保持着分化成成骨细胞系的能力。藻酸盐氧化程度显著地影响包裹的干细胞的活性。未氧化的藻酸盐中细胞数量明显少于氧化后的(p<0.05)。[Fig. 1(f)]
经过4周成骨诱导培养后,XO染色的结果表明, 包裹有PDLSCs和GMSC的藻酸盐微珠比阴性对照组产生了更多矿化组织 [Fig.2(a)]。此外,包裹有PDLSCs的藻酸盐水凝胶的XO阳性率在所有时间点均与阳性对照组相当(p>0.05) [Fig. 2(b)]。但是,GMSC组的矿化程度显著低于hBMSC组(阳性对照组)。同时,成骨相关的基因,如Runt相关转录因子2(Runx2),骨涎蛋白和骨钙素,在PDLSC组,GMSC组及阳性对照组(hBMSCs)均有较高的表达[Fig. 2(c)]。荧光显微镜对XO染色的评估显示沉积的矿物质直径在10 到40 mm。而且,本研究观察到包裹的各干细胞组的矿化量从1到28天期间显著增加(p<0.05)。统计学分析显示PDLSCs和阳性对照组之间无显著性差异。ARS 及XO矿化染色显示PDLSCs组及GMSC组早在第7天即可形成矿物沉积,并在第28天增加至最初4倍。
培养14天后,包裹的PDLSCs、GMSC和BMSC的共聚焦显微镜观察证实在藻酸盐水凝胶中培养2周后,干细胞表达其特异性的细胞标记[Fig. 3(a)]。此外,在固定和脱水后扫描电镜观察成骨诱导培养4周的微球形态,发现微珠中干细胞和矿化组织的存在[图3(b)]。图 3(c) 展示了包裹的干细胞的碱性磷酸酶活性。在成骨培养基中,BMSC在各个时间点均表现出最高的碱性磷酸酶活性 (12.8+-2.6),继而是PDLSCs (10.3+-2.0)(p>0.05)和GMSC(7.3+-1.7)(p<0.05)。然而,在每个时间点,BMSC和PDLSCs的碱性磷酸酶活性没有显著性差异(p>0.05),但GMSC碱性磷酸酶活性显著较低。每组碱性磷酸酶活性都在第14天达到峰值。和实验组相比,培养在普通培养基的对照组未观察到明显的碱性磷酸酶活性(p<0.01)。
体内实验
动物处死前的标准射线片显示PDLSCs、GMSC和阳性对照组均出现了大量的皮下钙化区。但是,在阴性对照组,即未包裹细胞的藻酸盐未观察到钙化区 [图4(a)]。另外,实验组和阳性对照组的x射线衰减的强度与邻近的骨组织类似,micro-CT结果表明作为阴性对照的未包裹干细胞的藻酸盐微珠组在植入8周后未明显地促进钙化[图 4(c)]。相反,包裹干细胞的藻酸盐微珠在皮下注射8周后出现广泛钙化区。micro-CT结果明显地显示,钙化不仅局限在每个微珠的表面(周围矿化)。如图4(d)所示,与PDLSCs组及GMSC组相比,BMSC组明显有更高的骨体积分数(BV/TV)。不过,PDLSCs组与GMSC组也有较大的矿化量。样本的组织学分析结果同放射片和microCT结果基本一致[图4(e)]。其结果显示存在矿化组织的形成,部分未吸收的藻酸盐,和一些结缔组织,并在阴性对照组中更加明显。通过特异性的抗体对人线粒体的免疫染色证实了植入物中人来源的细胞成分[图 4(f)]。对组织切片的组织形态学分析表明矿化区域的百分率同microCT 结果一致[图 4(f)]。阳性对照组的矿化量显著高于PDLSCs组(p<0.05)及GMSC组(p<0.01)。
讨论
在本研究中,我们第一次展示包裹在可注射、可生物降解、具有诱导成骨特性的藻酸盐三维支架材料中的PDLSCs及GMSC的活性和成骨能力。我们所研制的微型胶囊系统完全达到可注射、可生物降解,及可控(光)固化的能力。此研究与Tomar等的研究一致,证实在同源或异源的干细胞治疗应用中,PDLSCs及GMSC是比hBMSCs更好的细胞来源。
被包裹固定于藻酸盐水凝胶微珠中的干细胞在培养7到28天后仍可保持较高的活性,这说明有在微珠内部有养分的内流及充足的氧气给予细胞。稳定的细胞数量(在此实验期间相对恒定)和以往的文献一致29。另外,细胞的代谢产物也可以高效的外输,而且并未对细胞的活性产生影响。据报道,这可能是由于包裹的体系较小(此研究中,微珠的直径为1±0.1mm),使内流的营养物质与包裹的细胞产生的代谢产物达到了平衡29,30。包裹的细胞在包裹4周后仍保持活性。活细胞的密度从1到28天显著降低,这是由于培养过程中藻酸盐微珠的持续膨胀31,32。此外,包裹的细胞的活性明显都到藻酸盐水凝胶生物降解性的影响。通过提高藻酸盐水凝胶的氧化程度,可明显提高干细胞的活性,因而揭示了作为牙源性干细胞通用的支架,藻酸盐具有化学反应及生物活性的可维持性。CLSM显示包裹的PDLSCs、GMSC及hBMSC均表达了间充质干细胞的表面标记CD73和CD146,而不表达阴性标记物CD34。
体外研究的组织化学染色表明各种类型干细胞的矿物形成量从第1天到28天显著增加。此外,SEM的结果与Weir等人之前的研究一致,证明经过体外成骨诱导培养1个月后,藻酸盐支架材料中出现了磷灰石样的矿化组织。
在体内实验中,放射线检查、microCT和HE染色分析表明藻酸盐水凝胶中的hBMSCs、PDLSCs及GMSCs能产生矿化组织,而在阴性对照组则无矿化组织的产生。有研究已经证实按照有机模板的晶体成核及生长发生在暴露的阴离子基团重复模式的表面。此外,带负电的基团聚集并产生局部过饱和的阳离子,继而引起晶体的定向成核形成。藻酸盐包含带负电荷的区域,这可能使藻酸盐多糖链在骨组织工程中促进钙化的形成。
本研究可作为在骨组织工程中对牙源性干细胞及这类细胞合适的运载品评价的基础工作,如藻酸盐水凝胶。为了实现干细胞介导的骨组织工程这一终极目标,一个最佳的、具有生物相容性的载体需要与合适类型的干细胞相匹配。本研究发现藻酸盐微珠能够在较长时间里促进细胞的活性。本研究首次提出可注射、交联的藻酸盐微珠复合PDLSCs及GMSC系统,并且在体外没有预矿化即可在体内实现诱导成骨。预期的干细胞-支架结构能够形成一个表型上、基因上和功能性的类骨组织。所拟建的系统与骨移植物相比具有多种潜在的优势,包括消除不良免疫反应、降低系统性副作用、适于微创牙科的应用和整形外科重建。同hBMSC相比,PDLSCs及GMSC具有更优的生长特性和高产量,这使牙源性的干细胞具有极佳的治疗用途。
在将来,这种结构将进一步应用于颅顶骨缺损和牙周缺损动物模型,以便进一步研究PDLSCs及GMSCs的骨再生能力。藻酸盐氧化的程度也将优化以产生良好的降解和机械性能。我们会及时报告这些工作的结果。
结论
本研究报告了一个以运载PDLSCs和GMSCs,可注射、交联的藻酸盐微珠呈递系统,其可以在不体外预矿化的条件下而原位矿化。包裹于藻酸盐微珠内的PDLSCs及GMSCs在体内和体外均展示了较高的诱导成骨能力。据我们所知,这是藻酸盐水凝胶第一次在动物模型中用作PDLSCs及GMSCs的支架。藻酸盐支架可被处理及氧化成可溶性低聚物,避免因需取出支架材料而额外的复诊。这种骨组织工程系统具有促进硬组织再生的潜力,以实现微创牙科和整形手术。
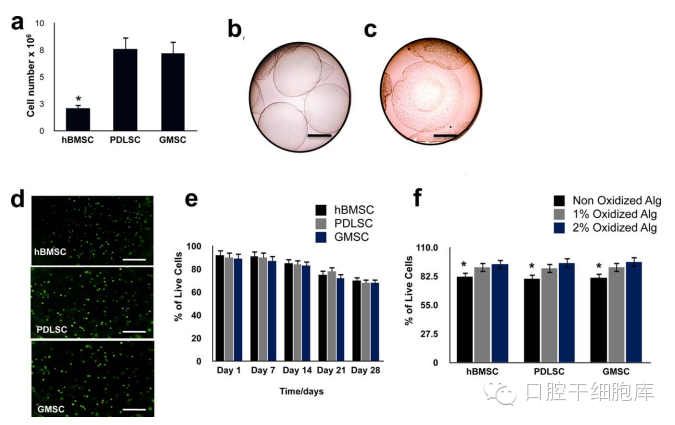
图1示
(a) 以5×105个细胞接种,传3代后细胞计数的结果。六次独立的实验均显示了相似的结果。
(b)和(c)干细胞微胶囊系统的培养。水凝胶微珠保持了其球形形态(标尺,500μm)。包裹干细胞的微胶囊系统的显微图像显示其均一的大小及细胞(圆点)分布(胶囊的平均直径为1±0.1 mm;标尺,500μm)。数据均用平均值±标准差表示。
(d)包裹hBMSC、hPDLSCs及GMSCs的藻酸盐微珠在常规培养基中培养7天后的calcein-AM和ethidium homodimer-1活/死细胞染色结果(标尺,200μm)。活细胞被染绿,死细胞被染红。约70%的细胞在封装后培养30天仍具有活性。(e)定量分析显示在7、14、21、28天后包裹的细胞的活细胞比率。
(f)藻酸盐的氧化程度显著的影响包裹的干细胞的活性。未氧化的藻酸盐较氧化后的藻酸盐活细胞数明显减少(p<0.05)。[彩图可见于wileyonlinelibrary.com网上期刊]
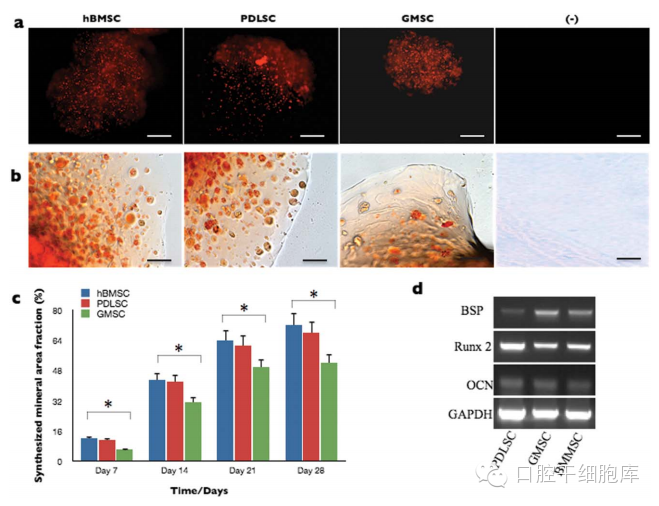
图2示 组化染色结果和成骨标志基因的表达分析。
(a)包裹于藻酸的干细胞在成骨培养基培养28天后XO染色所示的矿化作用(标尺,200μm)。
(b)矿化区域的比率(矿化的染色面积/镜下观察到的视野面积)。所检测的各组干细胞在各时间点所形成的矿化组织的量没有显著差异(p>0.05)。矿化的结果证实矿化量随着时间增加而不断增加。
(c)三种包裹的干细胞在成骨诱导分化后的RT-PCR结果分析。GAPDH(看家)基因的表达作为阳性对照。未包裹细胞的藻酸盐水凝胶作为阴性对照。[彩图可见于wileyonlinelibrary.com网上期刊]
图3示
(a)包裹于藻酸盐中的干细胞被FITC共轭的CD146及TRITC共轭的CD73染色,并DAPI复染。CLSM图像展示了培养14天后的包裹有细胞的藻酸盐支架。PDLSCs、GMSC及hBMSC均表达间充质干细胞的表面标记CD73和CD146,但不表达阴性标记物CD34。
(b)hBMSC 、PDLSCs及GMSC包裹于藻酸盐微珠的扫描电镜图。图片分别展示了藻酸盐水凝胶、包裹有细胞但未诱导成骨的藻酸盐微珠、在成骨诱导培养基中培养4周且有矿化形成的干细胞微胶囊的形貌。(断面:在微珠中的圆形的细胞)。
(c)包裹于藻酸盐水凝胶微珠中的干细胞的碱性磷酸酶活性。每组5个。碱性磷酸酶活性值与DNA浓度做标定,单位是mM pNpp min-1/ug DNA,p<0.05; p<0.01。[彩图可见于wileyonlinelibrary.com网上期刊]

图4示
(a)植入8周后样本的放射片。皮下植入的藻酸盐-细胞团块可由阻射的钙化结节确认。hBMSC、 hPDLSCs和GMSC组中均有大量矿化物出现,而在阴性对照组未观察到。
(b)植入8周后干细胞接种的支架的代表图。
(c)包裹的细胞及阴性对照组的microCT影像显示的三维microCT构建的异位矿化组织。
(d)通过microCT定量分析每个干细胞-藻酸盐结构的骨体积分数(BV/TV)。
(e)组织学分析:(左侧是10×低倍镜和右侧40×高倍镜)皮下植入8周后组织HE染色提示骨的存在(B),未吸收的藻酸盐水凝胶(Alg)及结缔组织(CT)。
(f)特异性抗人线粒体的抗体(箭头)的免疫染色证明人源性细胞(黑箭头)的存在。(g)如(d)所示,对每组矿化面积量的定量分析(%总面积)(标尺,100μm)*, p<0.05; **, p<0.01. [彩图可见于wileyonlinelibrary.com网上期刊]
感谢
作者声明对本文的作者和/或出版无潜在的利益冲突。





